
|
Elektronen zijn volgens de klassieke fysica zeer kleine keiharde bolletjes die in cirkel- en ellipsvormige banen rond de kern van een atoom draaien. Zij zijn de absolute basis van de elektronica.
|
Via golven naar vrije elektronen
Elektromagnetische golven
Dit artikel begint met wat een zijsprong lijkt te zijn: elektromagnetische golven. De bespreking van dit verschijnsel is echter absoluut noodzakelijk om een bijzondere eigenschap van elektronen te kunnen begrijpen.
Stralende elektronen
Het blijkt namelijk dat elektronen onder bepaalde omstandigheden licht kunnen uitstralen. Een eigenschap die zeer belangrijk is in de elektronica, want zonder deze eigenschap zouden er bijvoorbeeld geen LED's bestaan.
Vrije elektronen
Nadien worden de elektronen losgekoppeld van hun atomen, want dat is absolute noodzaak voor het vloeien van elektrische stroom. Dergelijke elektronen noemt men vrije elektronen en hoe de fysische processen werken die elektronen kunnen bevrijden uit hun atoom vormt het laatste onderwerp van dit artikel.
Elektromagnetische golven
Elektrische en magnetische velden
In de loop van de negentiende eeuw had men een goed inzicht gekregen in de structuur van licht. Licht, zo wist men, was een onderdeel van het elektromagnetisch stralingsspectrum. Straling die ontstaat doordat magnetische en elektrische velden een wisselwerking met elkaar aangaan. Een variërend elektrisch veld veroorzaakt een variërend magnetisch veld. Dit veld veroorzaakt dan weer een variërend elektrisch veld, etc. Die gecombineerde velden veroorzaken een golfverschijnsel in de ruimte, een elektromagnetische golf. Die golf wordt gekenmerkt door een golflengte λ (lambda), die wordt uitgedrukt in meter.
 |
| Een elektromagnetisch golfverschijnsel in de ruimte. (© 2017 Jos Verstraten) |
De snelheid van elektromagnetische golven
De snelheid waarmee dit verschijnsel zich voortplant door de ruimte is gelijk aan 299.792,5 km/s! Dat betekent dat een elektromagnetische golf in één seconde ongeveer 7,5 keer rond de aarde kan reizen!
Het elektromagnetisch spectrum
Het zichtbare licht vormt maar een heel klein gedeelte van het elektromagnetisch spectrum. Radio-, TV- en radargolven vormen het gebied met de lange golflengten, van ongeveer 1.000 m tot ongeveer 1 mm. Nadien volgt het infrarode gebied, elektromagnetische warmtestraling die iedereen kent van de zon, de hoogtezon en elektrische radiatoren. Nadien komt het uiterst smalle gebiedje van het zichtbare licht. Het rode licht heeft de langste golflengte, het violette licht de kortste. Vervolgens komt het gebied van de ultraviolette straling, gevaarlijk voor de menselijke huid. Bij nog kortere golflengtes (dan moet men denken aan 10-8 m) spreekt men van röntgenstraling, bekend van het ziekenhuis en gammastraling, die erg gevaarlijk is voor de gezondheid. Hoewel al deze soorten straling nogal verschillend lijken, is de basis steeds hetzelfde: een zich in de ruimte met constante snelheid voortplantende interactie van elektrische en magnetische veldlijnen.
 |
| Het elektromagnetisch spectrum. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Sommige bronnen van elektromagnetische straling zenden slechts één welbepaalde golflengte uit, bijvoorbeeld een ongemoduleerde radiozender of een laser. De meeste elektromagnetische bronnen zenden echter een samengesteld signaal uit, waarin verschillende golflengten aanwezig zijn. Een typisch voorbeeld is de zon, die elektromagnetische straling uitzendt van ver in het infrarode tot ver in het ultraviolette gebied. Men heeft apparaten ontwikkeld waarmee men de golflengtesamenstelling van dergelijke straling kan onderzoeken. Deze apparaten noemt men 'spectroscopen'.
Het glazen prisma
De eenvoudigste spectroscoop is een glazen prisma, waarmee men het zonlicht kan ontleden. De opstelling bestaat uit een licht ondoorlatende plaat, waarin een klein gaatje is aangebracht. Via dit gaatje valt het zonlicht op het glazen prisma. De elektromagnetische straling van de zon wordt door dit prisma gebroken. Iedere golflengte heeft echter een andere brekingshoek. Het gevolg is dat de smalle invallende witte zonnestraal wordt omgezet in een brede bundel, waarin men alle kleuren van de regenboog herkent. Als men deze bundel op een wit scherm projecteert ziet men de prachtige kleuren van de individuele golflengtes van het zonlicht, van diep rood tot violet. Via ingewikkelder apparatuur is het ook mogelijk de voor de mens niet zichtbare elektromagnetische straling te ontleden in de samenstellende golflengten.
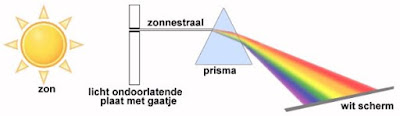 |
| De eenvoudigste spectroscoop is een glazen prisma. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Atomen en straling
Gasontladingsbuis
Als men waterstofgas opsluit in een glazen buis en over de buis een grote gelijkspanning aanlegt zal het waterstofgas, zoals reeds beschreven in Atomen, de basis van de materie, licht uitstralen. Als men dit elektromagnetisch verschijnsel door middel van een spectroscoop gaat ontleden stelt men iets merkwaardig vast. Het elektromagnetisch spectrum dat door waterstof wordt uitgestraald bestaat niet uit een continu spectrum, zoal bij het zonlicht, maar uit welbepaalde golflengtes. Ieder lijntje in de tekening stelt een welbepaalde golflengte voor uit het opgevangen en geanalyseerd waterstoflicht.
Het blijkt dat alle stoffen een dergelijk lijnenspectrum bezitten. De verdeling van de lijnen is zelfs zo specifiek voor een stof dat men deze als een soort vingerafdruk van de stof kan beschouwen.
 |
| Het elektromagnetisch spectrum van waterstof. (Wikimedia Commons, bewerkt door Jos Verstraten) |
De vraag die natuurkundigen moesten beantwoorden was waar deze typische lijnen vandaan kwamen. Nu was reeds bekend dat voor het uitzenden van elektromagnetische straling energie nodig is. De enige voorwerpen in een atoom die dergelijke energie bezitten zijn de elektronen, die immers met grote snelheid (en dus energie) rond de kern draaien. Zouden de elektronen echter de elektromagnetische straling uitzenden, dan zouden zij energie (en dus snelheid) verliezen. Het gevolg zou zijn dat de elektronen dichter rond de kern gingen draaien en tot slot zelfs op de kern zouden neerstorten. Dat is duidelijk in strijd met de waarnemingen!

Een nieuw atoommodel van Bohr
De Deense natuurkundige Niels Bohr ontwikkelde rond 1914 een theorie die deze vreemdsoortige lijnenspectra kon verklaren. Bohr had in zijn studietijd samengewerkt met Thomson en met Rutherford en kende de bestaande atoommodellen als de inhoud van zijn broekzak. Maar hij was dus ook goed op de hoogte van de problemen rond deze modellen. Bohr stelde nu een nieuw atoommodel samen, die in feite mooi aansloot op het planetair model van Rutherford, maar een verklaring gaf voor de stationaire banen van de elektronen en voor het uitzenden van de lijnenspectra.
De stellingen van Bohr
Bohr stelde:
- Elektronen kunnen alleen op welbepaalde banen (schillen) rond de kern draaien (niets nieuws!). Door gebruik te maken van bepaalde stellingen van de quantummechanica van Max Planck kon Bohr echter de stralen van deze banen berekenen. En dat was wél nieuw, want daarmee was de vraag naar het waarom van de waargenomen schillen opgelost.
- In strijd met alles wat de elektromagnetische theorie van Maxwell beweert zenden de elektronen op deze banen géén energie uit. Bohr loste deze tegenstelling op door te beweren dat de traditionele elektromagnetische theorie niet van toepassing is in de kleine-schaal structuur van een atoom. De elektronen kunnen dus tot in de eeuwigheid rustig doorgaan met op deze banen te draaien, omdat dit stationaire toestanden voor het atoom zijn. Deze stationaire schillen noemt men de 'Bohr-banen' van de elektronen. Elektronen zullen dus bij voorkeur een plekje op een van de Bohr-banen opzoeken, omdat dit de meest stabiele toestand van het atoom is.
- Iedere baan of schil komt overeen met een welbepaalde rustenergie van de elektronen. Deze energie hangt af van de afstand tussen de kern en de schil. Als er extra energie aan het atoom wordt toegevoegd, bijvoorbeeld door het op te warmen of aan een sterk elektrisch veld bloot te stellen, kunnen elektronen deze energie absorberen. Zij zijn dan in staat naar een baan of schil te springen die een hogere rustenergie heeft. Voorwaarde is dan wel dat er voldoende energie aan het atoom is aangeboden om het verschil in rustenergie tussen beide schillen te overwinnen. Een elektron dat door toevoeging van extra energie zijn stationaire Bohr-baan verlaten heeft noemt men een 'aangeslagen' elektron.
- Op dat moment is het atoom in een instabiele toestand. Het aangeslagen elektron zal zo snel mogelijk terug vallen naar zijn stationaire Bohr-baan. Hierbij zendt het elektron echter weer een hoeveelheid energie uit onder de vorm van elektromagnetische straling. De uitgezonden hoeveelheid energie is gelijk aan het verschil in rustenergie tussen beide schillen. De overgang van een elektron van aangeslagen toestand naar stationaire Bohr-toestand noemt men een 'quantumsprong'.
Verklaring van de lijnenspectra
Met deze stellingen kon Bohr het uitzenden van lijnenspectra verklaren. Iedere golflengte in het spectrum komt immers overeen met de sprong van een aangeslagen elektron van een buitenste schil naar een binnenste schil. Omdat er heel wat sprongen tussen de zeven schillen mogelijk zijn, kan men dus ook heel wat golflengtelijnen in een spectrum verwachten.
De theorie klopt!
Het was mogelijk de energieën te berekenen die overeen komen met alle mogelijke quantumsprongen van een aangeslagen elektron. Als men de energie weet die bij zo'n sprong vrijkomt, dan kan men ook de daarmee overeen komende golflengte van de elektromagnetische straling berekenen. Hoe hoger de energie die vrijkomt, hoe kleiner de golflengte van de opgewekte straling. Iedere quantumsprong genereert dus één golflengtelijn in het lijnenspectrum van het atoom dat men onderzoekt. Nadien hebben talloze experimentele natuurkundigen geprobeerd alle lijnen terug te vinden die volgens de theorie van Bohr met alle mogelijke quantumsprongen overeen komen. In onderstaande figuur zijn de namen vermeld van de wetenschappers die de lijnstructuur van waterstof volledig ontrafeld hebben. Bovendien is aangegeven welke golflengtes van welke quantumsprongen zij waargenomen hebben.
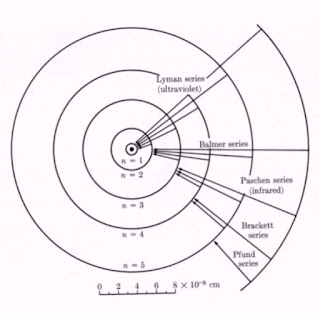 |
| Overzicht van de quantumsprongen van een elektron in een waterstofatoom. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Het zal duidelijk zijn dat de beschreven natuurkundige eigenschappen van het elektron van zeer groot belang zijn voor de elektronica. Van het feit dat elektronen elektromagnetische straling produceren als zij van een aangeslagen in een stationaire toestand terug vallen wordt in tal van elektronische onderdelen gebruik gemaakt. Te denken valt aan:
- Beeldbuizen.
- LED's.
- Luminiscerende panelen.
- TL-buizen.
- Indicatorbuizen.
De basis van de optische elektronica
Bij deze onderdelen worden eerst door het toevoegen van externe energie de atomen in aangeslagen toestand gebracht. Een elektron wordt eerst 'geëxiteerd' van baan 0 naar baan 1 en zal nadien terug vallen naar zijn stationaire baan. Op dat moment wordt elektromagnetische straling met een welbepaalde golflengte uitgestraald. Tegenwoordig heeft men een zo goed inzicht in deze fysische processen, dat men zuiver theoretisch kan berekenen aan welke eigenschappen de stoffen moeten voldoen om een bepaalde kleur van het licht te verkrijgen. Het komt er nadien alleen op aan de noodzakelijke grondstoffen op een reproduceerbare en goedkope manier op industriële schaal te maken.
 |
| Verklaring van het uitzenden van elektromagnetische straling door een elektron. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Toen de wetenschap de beschikking kreeg over zeer nauwkeurige spectroscopen en men hiermee de spectrale lijnen van waterstof grondig ging onderzoeken, bleek dat de enkelvoudige lijnen in feite waren samengesteld uit verschillende lijnen, die heel dicht bij elkaar lagen. Dit noemde men de 'fijnstructuur' van het spectrum. De theorie van Bohr had hiervoor geen verklaring. Die verklaring werd door Sommerfeld geleverd. Deze veronderstelde dat elektronen niet alleen in cirkelvormige banen rond de kern kunnen draaien, maar ook in elliptische. Er zijn dan, per schil, veel meer rustenergieën mogelijk, met als gevolg ook veel meer overgangen van schil naar schil. De rustenergieën in een ellipsvormige baan liggen echter zeer dicht bij elkaar en dus ook de golflengtes van de uitgezonden elektromagnetische straling. Door zeer nauwkeurig onderzoek van de fijnstructuur stelde Sommerfeld het model op dat is toegelicht in onderstaande figuur:
- De K-schil heeft één cirkelvormig baan.
- De L-schil heeft één cirkelvormige en één ellipsvormige baan.
- De M-schil heeft één cirkelvormige en twee ellipsvormige banen.
- Etc.
In iedere baan kunnen natuurlijk weer slechts een bepaald aantal elektronen voorkomen. Het totaal per schil blijft echter gelijk aan dat wat Rutherford reeds stelde. Deze verfijning van het model van Bohr biedt ook een eenvoudige verklaring voor de elektrische geleidbaarheid van sommige stoffen.
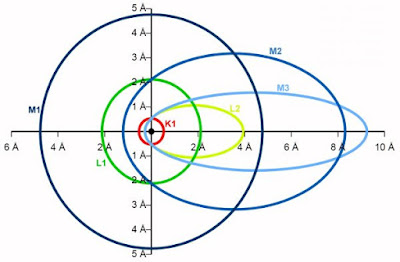 |
| Ellipsvormige banen lossen het probleem van de fijnstructuur van het spectrum op. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Het atoommodel van Sommerfeld is de meest verfijnde benadering van de natuurkundige realiteit van het atoom waar de klassieke mechanica toe in staat is. Toch laat ook dit model vele vragen open. Een groot deel van deze vragen kan beantwoord worden als men het atoom niet langer beschouwt als een soort miniatuur zonnestelsel met harde materiebolletjes, maar als een samenhang van materievelden. De quantummechanica biedt hiertoe de theoretische, volledig wiskundig beschreven basis. Maar deze ingewikkelde theorie valt volledig buiten het bestek van deze dit artikel! Voor het begrijpen van de natuurkundige basis van de elektronica kan men volledig terug vallen op het atoommodel van Sommerfeld.
De samenstelling van de atoomkern
Niet behandeld is bovendien de samenstelling van de atoomkern, omdat dit voor de elektronica niet belangrijk is. Voor de volledigheid wordt alleen even vermeld dat de kern bestaat uit protonen en neutronen. De protonen zijn de dragers van de positieve elektrische lading en ieder atoom bevat even veel protonen als elektronen. De neutronen zijn niet geladen, maar hebben wel een aanzienlijke massa. Vanwege hun elektrische neutraliteit vervullen neutronen geen enkele rol in elektrische en elektronische verschijnselen.
Vrije elektronen in geleiders
Emissie van elektronen
Elektronen zijn de basis van de elektrische stroom. Elektrische stroom bestaat immers uit een verplaatsing van een grote hoeveelheid elektronen in een welbepaalde richting in een welbepaalde tijd. Maar zolang elektronen gebonden zijn aan een atoomkern kan er van het vloeien van elektrische stroom geen sprake zijn. De volgende vraag die dus beantwoord moet worden is hoe elektronen aan hun atoomgevangenis kunnen ontsnappen. Ook dat heeft meestal te maken met het toevoeren van voldoende energie aan een atoom. Net zoals een elektron van zijn Bohrse baan naar een verder gelegen baan kan worden verplaatst, kan dat elektron ook zodanig versneld worden, dat het uit het atoomverband ontsnapt. De hoeveelheid energie die hiervoor nodig is noemt men de 'uittreedenergie', voorgesteld door het symbool φ (phi). Het verschijnsel van het uittreden van elektronen noemt men 'emissie'.
De uittreedenergie
De uittreedenergie is van een groot aantal omstandigheden afhankelijk. In het algemeen geldt dat atomen die een volledig gevulde hoogste schil hebben, aanzienlijk meer energie moeten absorberen om een elektron te laten ontsnappen dan atomen waarbij de laatste schil zo goed als leeg is.
Extern elektrisch veld
Een tweede voorwaarde voor het vloeien van elektrische stroom is dat er een elektrisch veld aanwezig is over de geleider. In sommige stoffen, zoals metalen, zijn de buitenste elektronen zo zwak aan hun atoom gebonden dat zij van atoom naar atoom kunnen zwerven. Toch veroorzaken deze reeds vrije elektronen geen elektrische stroom! Het is immers niet voldoende de elektronen te bevrijden uit hun atomen. Zonder extern elektrisch veld zouden deze elektronen als een soort wolk willekeurige bewegingen uitvoeren van atoom tot atoom. Maar door het aanleggen van een extern elektrisch veld zullen de vrije elektronen aangetrokken worden door de positieve lading van het veld, waardoor de elektronenstroom op gang komt.
Vrije elektronen in geleiders
In onderstaande figuur is getekend hoe men zich het ontstaan van vrije elektronen in een goede geleider volgens het atoommodel van Sommerfeld kan voorstellen. In metalen liggen de atomen dicht op elkaar. Een van de elektronen van het linker atoom zit in een elliptische baan. Op bepaalde momenten bevindt dit elektron zich dus op een afstand a van de eigen kern. Door de dichtheid van de atomen bevindt dit elektron zich op dat moment echter op een identieke afstand a van een naburig atoom (het rechtse). Op dat moment kan het elektron zonder veel moeite overspringen van het ene naar het andere atoom. Dat verschijnsel gebeurt natuurlijk niet eenmalig, maar miljarden keer per seconde.
 |
| Het ontstaan van vrije elektronen in geleiders. (© 2017 Jos Verstraten) |
Miljarden elektronen bewegen zich dus van atoom naar atoom door de stof. Zonder externe invloeden is deze beweging chaotisch en gemiddeld bekeken verandert er niets. Legt men nu echter een kleine elektrisch spanning aan over het metaal, dan ontstaat over de geleider een elektrisch veld. Dit veld oefent een kracht uit op de vrije elektronen, waardoor deze in een door de richting van het veld bepaalde richting gaan bewegen. De chaotische beweging wordt gestructureerd. Dit verschijnsel plant zich razendsnel door het metaal voort, met als gevolg dat er een stroom van elektronen van de negatieve naar de positieve pool op gang komt. De zware kernen zitten vast in de kristalstructuur van het metaal en kunnen zich niet verplaatsen. In een geleider zijn het dus alleen de zeer lichte vrije elektronen die de elektrische stroom veroorzaken.
Thermische emissie
De meest voorkomende manier om elektronen uit hun atoomstructuur te bevrijden is thermische emissie. Warmte uit zich op microscopische schaal doordat de bouwstenen van de stof gaan trillen. Deze bewegingen gaan natuurlijk gepaard met toename van de energie. Als dus atomen, die een zeer lage uittreedenergie hebben, warm worden dan zal de opwarming al voldoende extra energie aan de elektronen geven om deze uit hun atoomverband te bevrijden. Het volstaat dan een uitwendig elektrisch veld aan te leggen om de elektronenstroom te laten vloeien. Nu moet men bij het begrip opwarming niet denken aan het heet stoken van een stof. In de natuurkunde verstaat men onder opwarmen het verhogen van de temperatuur van een stof boven het absolute nulpunt van -273,16 °C. Een stof die op een temperatuur staat van -200 °C is, natuurkundig bekeken, dus al flink opgewarmd!

Lekstromen afhankelijk van temperatuur
De thermische emissie is de oorzaak van het verschijnsel dat de lekstroom van halfgeleiders toeneemt naarmate het kristal warmer wordt.
Beeldbuizen werken dank zij thermische emissie
Thermische emissie werd bijvoorbeeld in de ouderwetse beeldbuizen gebruikt om de elektronen te genereren, waaruit de elektronenstraal wordt opgebouwd. Door middel van een gloeidraad of filament wordt de kathode heet (deze keer letterlijk op te vatten!) gestookt. De wolk vrije elektronen die door de kathode wordt uitgezonden wordt door middel van ingewikkelde elektrostatische en magnetische lenzen en versnellers omgezet in een zeer dunne elektronenstraal, die door de luchtledige glazen beeldbuis op het scherm wordt gericht.
 |
| Thermische emissie in de kathode van een beeldbuis wekt een wolk vrije elektronen op. (© 2017 Jos Verstraten) |
De noodzakelijke uittreedenergie kan ook worden aangeboden onder de vorm van elektromagnetische straling. Uit de algemene wetten van het elektromagnetisme is bekend dat de energie van de straling omgekeerd evenredig is met de golflengte. Bestraalt men dus een stof met elektromagnetische straling dan zal er een moment optreden waarbij de straling zoveel energie in de atomen van de bestraalde stof pompt, dat elektronen uit hun atoomverband kunnen ontsnappen. Het aanleggen van een extern elektrisch veld volstaat dan weer om de bevrijde elektronen in één richting door de stof te laten vloeien. Foto-emissie is de natuurkundige basis van een aantal elektronische onderdelen, zoals fotodioden, fototransistoren en cadmiumsulfide cellen (LDR's).
Secundaire emissie
Elektronen kunnen ook uit hun atomen bevrijd worden door de stof te bombarderen met zeer energierijke elektronen. Deze elektronen botsen tegen de aan atomen gebonden elektronen. Bij een botsing vindt er steeds energie-overdracht plaats. Sommige gebonden elektronen worden hierdoor zo energierijk dat zij uit het atoomverband kunnen ontsnappen. Als de energie van de invallende elektronen zo groot is dat zij in staat zijn meerdere elektronen uit hun atomen te bevrijden, spreekt men van 'secundaire multiplicatie'. Dit effect treedt bijvoorbeeld op in fotovermenigvuldigers, waar men eerst via foto-emissie enkele elektronen bevrijd uit een plaat. Nadien worden deze elektronen versneld door een elektrisch veld. De versnelde elektronen laat men dan tegen een tweede plaat botsen. De primaire elektronen zijn ondertussen zo energierijk door de versnelling geworden, dat zij in staat zijn met verschillende gebonden elektronen te botsen en deze uit hun atomen te bevrijden. Door het beschreven proces herhaalde malen te herhalen kan men een secundaire multiplicatie met een factor van 100 tot 10.000 verkrijgen.
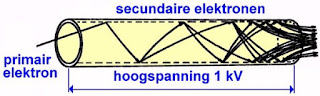 |
| Secundaire emissie van elektronen, toegepast in een elektronische beeldversterker. (Wikimedia Commons, bewerkt door Jos Verstraten) |

|

|
Koop uw componententester bij AliExpress
