Wat is elektrochemie?
Van chemische naar elektrische energie en vice versa
De elektrochemie houdt zich bezig met twee verschijnselen. Op de eerste plaats de omzetting van chemische energie in elektrische, processen die aan de basis staan van accumulatoren en batterijen. Daarnaast de omzetting van elektrische energie in chemische, samen te vatten onder de termen elektrolyse en galvanotechniek. Met deze technieken is het mogelijk waterige oplossingen van zouten te ontleden in hun atomen, maar ook een stuk metaal te voorzien van een dunne laag van een ander metaal. Vooral dat laatste procedé kent tal van toepassingen, heel veel gouden sieraden zijn eigenlijk gemaakt van zilver, waarop een heel dun laagje goud is aangebracht. Ook in de elektronica wordt veel gebruik gemaakt van galvaniseren. Koperen printen worden galvanisch voorzien van een dun laagje tin om de soldeerbaarheid te verhogen. De edge-connectoren van printen worden op dezelfde manier voorzien van een dun laagje goud. Hetzelfde gebeurt met de contacten van het betere soort relais en schakelaars. Kortom, de elektrochemie heeft tal van onvermoede toepassingen.
Historische ontwikkeling
Elektriciteit en chemie
Dat elektriciteit en chemie van alles en nog wat met elkaar te maken hebben was al heel vroeg in de geschiedenis duidelijk. Men wist uit ervaring dat elektriciteit in staat is spieren te laten samentrekken. Een van de primitiefste manieren om de aanwezigheid van elektriciteit te detecteren was gebruik te maken van de grote spier in de poot van een vers geslachte kikker. Als men de twee uiteinden van deze spier via geleidende draden verbond met twee punten, waartussen men de aanwezigheid van elektriciteit vermoedde en de spier trok samen, dan wist men dat het vermoeden juist was.
Luigi Galvani
Uit experimenten bleek echter ook dat kikkerspieren konden samentrekken zonder dat er sprake was van externe elektriciteit. Een van de eerste onderzoekers die een fundamenteel onderzoek naar deze verbanden heeft ingesteld, was de Italiaan Luigi Galvani. Een van zijn beroemdste proeven was het kikkerexperiment. Als u, zoals geschetst in onderstaande figuur, de twee uiteinden van een kikkerspier verbindt met twee draden die uit verschillende metalen zijn gemaakt en u verbindt die twee draden met elkaar, dan zult u vaststellen dat de spier krachtig samentrekt.
Galvani trok hieruit de terechte conclusie dat in het gesloten systeem koper, ijzer en spier op de een of andere manier elektriciteit aanwezig was. Galvani was echter nog te zeer een man van zijn tijd om hieruit echte wetenschappelijke conclusies te trekken. Hij dacht dat de oorzaak van het verschijnsel 'dierlijke elektriciteit' was en was er zelfs een tijdje van overtuigd dat hij de 'universele levenskracht' had ontdekt.
 |
| Het beroemde experiment van Galvani dat aan de basis staat van de elektrochemie. (© Wikimedia Commons) |
Zijn landgenoot Allessandro Volta trok wél de juiste wetenschappelijke conclusie. Volgens hem was de spier niets meer dan het instrument waarmee de aanwezigheid van elektriciteit werd vastgesteld. De elektriciteit was het gevolg van het feit dat twee verschillende metalen in contact met elkaar werden gebracht. Immers, als men het experiment van Galvani uitvoerde met twee draden uit hetzelfde metaal gebeurde er helemaal niets. Volta ging experimenteel aan de slag met zijn visie en ontdekte al snel dat er helemaal geen dierlijk materiaal noodzakelijk was om elektriciteit te produceren. Als hij twee geleiders uit verschillend metaal in een geleidende oplossing bracht, dan ontstond er tussen de twee geleiders een spanningsverschil. Op deze manier was Volta in staat de eerste primitieve batterij te maken die door het leven gaat onder de naam 'Volta-cel', ook wel 'zuil van Volta' genoemd.
De Volta-cel
De Volta-cel bestond uit een glazen vat, gevuld met een verdunde oplossing van zwavelzuur. In dit vat werden een koperen en een zinken plaat opgehangen. Volta kon aantonen dat tussen de twee platen een spanning van ongeveer 1,1 V ontstond. Volta kon bovendien bewijzen dat zijn zuil niet alleen elektrische spanning genereerde, maar dat het ook mogelijk was er een elektrische stroom uit te trekken. Dat stelde de wetenschappers van die tijd voor een groot probleem. Het begrip 'elektron' was nog onbekend, maar men wist wel dat elektrische stroom uit 'iets' moest bestaan. Dat 'iets' moest dus ook door de geleidende oplossing van de Volta-zuil vloeien. Het zou nog heel lang duren voor dit verschijnsel wetenschappelijk verklaard kon worden.
Het principe van de elektrische cel
De bouw van de materie
Om het principe van de elektrische cel te doorgronden was het noodzakelijk dat de wetenschap iets meer zicht kreeg op de bouw van de materie. Toen men eenmaal zo ver was dat men wist dat stoffen bestaan uit moleculen en atomen en dat deze atomen een positieve kern hebben en een negatieve lading rond die kern opgeslagen in elektronen, kon men aan de slag om de door Volta en tijdgenoten experimenteel aangetoonde verschijnselen te verklaren.
Referenties
Wilt u meer weten over de bouw van de materie, lees dan mijn artikelen:
➡ Atomen, de basis van de materie
➡ Elektronen, basis van de elektronica
Elektrolytische dissociatie
In 1884 toonde de Zweedse scheikundige Svante Arrhenius aan dat als men bepaalde chemische stoffen oplost in water deze oplossing de elektrische stroom kan geleiden. Dergelijke stoffen werden 'elektrolyten' genoemd, een woord dat uit Griekse begrippen is samengesteld en vrij vertaald kan worden als 'vloeibare stoffen met elektrische eigenschappen'. Arrhenius vermoedde dat deze geleiding ontstond doordat de atomen van de stof zich splitsten in afzonderlijke positieve en negatieve delen, die zich vrij door de vloeistof kunnen verplaatsen. Deze geladen deeltjes werden 'ionen' genoemd. Omdat een atoom op zich elektrisch neutraal is, was het duidelijk dat de lading van alle positieve ionen in de vloeistof precies gelijk moest zijn aan de lading van alle negatieve ionen in de vloeistof, zodat het geheel toch elektrisch neutraal bleef.
Het verschijnsel dat stoffen, die op zich absoluut geen geleiders van elektriciteit zijn, dit wél gaan doen als zij opgelost worden in water, werd door Arrhenius 'elektrolytische dissociatie' genoemd.
Gedrag van vrije elektronen in metalen
Een tweede verschijnsel dat verklaard moet worden is hoe elektronen zich in metalen gedragen. Als u de vorige artikelen uit deze serie hebt gelezen weet u hoe elektronen in geleidende stoffen, zoals een blok metaal, vrij van atoom naar atoom kunnen bewegen. Men spreekt dan ook van 'vrije elektronen'. Een vrij elektron springt als het ware van atoom naar atoom en vormt dus een spoor van positieve ionen. Dat zijn atomen die een elektron kwijt zijn en daardoor positief geladen worden. Deze 'gaten' worden weer opgevuld door andere vrije elektronen, zodat het blok metaal op zich elektrisch neutraal is.
Beweging is echter een vorm van energie. De bewegende vrije elektronen in de geleider hebben dus een bepaalde kinetische bewegingsenergie. De grootte van deze energie is afhankelijk van de eigenschappen van de geleider. Energetische elektronen hebben in principe de mogelijkheid om volledig uit een atoomverband te ontsnappen. De kinetische energie van vrije elektronen in een metaal is echter te klein om de elektronen de mogelijkheid te geven uit het metaal te ontsnappen. Het brok metaal vormt als het ware een gevangenis voor de vrije elektronen, waaruit geen ontsnappen mogelijk is. Dat kan alleen als er op de een of andere manier extra energie aan de vrije elektronen zou worden aangeboden of als de noodzakelijke energie om uit te treden op de een of andere manier lager wordt. In een karakteristiek metaal is het tekort aan energie om te kunnen ontsnappen vrij klein, maar een paar elektronVolt (eV). Toch blijven de vrije elektronen in het metaal, omdat er geen mogelijkheid aanwezig is om deze extra energie te verwerven. Deze 'uittreed-energie' wordt in de natuurkunde aangeduid met de term 'arbeidsfunctie' of 'drempel potentiaal' en voorgesteld door de Griekse letter Φ. In onderstaande figuur is een grafische voorstelling gegeven van de energie van een vrij elektron in een brok metaal. Hieruit blijkt duidelijk dat deze energie naar nul streeft als het de rand van het metaal nadert.
 |
| De energie van een vrij elektron in functie van de positie ten opzichte van de rand van het metaal. (© 2017 Jos Verstraten) |
Het feit dat de vrije elektronen in verschillende metalen verschillende energieën hebben heeft zeer verstrekkende gevolgen. Stel dat u twee metalen zeer star aan elkaar bevestigt, bijvoorbeeld zink en koper. Beide metalen hebben verschillende waarden van Φ, met als gevolg dat er een energieverschil optreedt waar de atomen van het zink en de atomen van het koper elkaar raken. Dit wordt verduidelijkt aan de hand van onderstaande figuur.
 |
| Het Seebeck verschijnsel ontstaat door het verschil in energie tussen de vrije elektronen in twee metalen. (© 2017 Jos Verstraten) |
De cel van Volta
Dank zij het theoretische werk van Arrhenius en de beschreven ontwikkelingen in het denken over vrije elektronen was men in staat de cel van Volta wetenschappelijk te verklaren. Een moderne uitvoering van de cel van Volta bestaat, zie onderstaande figuur, uit een elektrolytisch bad gevuld met verdund zwavelzuur, waarin een koperen en een zinken plaat worden gedompeld. Deze platen worden de 'elektroden' genoemd.
 |
| De samenstelling van een moderne Volta-cel. (© 2017 Jos Verstraten) |
Stel dat beide platen door middel van een koperen staaf worden verbonden. Er ontstaat dan bij de zinken plaat een punt waar het koper en het zink innig met elkaar verbonden zijn, de 'koper/zink scheiding'. Zoals beschreven zal dit tot gevolg hebben dat elektronen uit het zink naar het koper kunnen ontsnappen. Via de koperen staaf kunnen deze elektronen zich echter vrijelijk verspreiden over het gehele koperoppervlak, zodat ook dat gedeelte van de koperen plaat dat ondergedompeld is een overschot aan elektronen gaat vertonen. Uiteraard zal de zinken plaat, die is ondergedompeld in de vloeistof een teveel aan positieve ionen gaan vertonen.

Er ontstaat dus een spanningsverschil tussen beide platen. U krijgt nu te maken met de reeds beschreven elektrolytische dissociatie. De atomen van het in het water aanwezige zwavelzuur worden onderworpen aan een spanningsverschil en zullen zich splitsen in positieve ionen en negatieve ionen. De positieve ionen worden echter door de negatieve elektronen in de koperen plaat aangetrokken. De negatieve ionen uit de vloeistof worden aangetrokken door de zinken plaat. De positieve ionen uit de vloeistof verenigen zich weer met de negatieve elektronen in de koperen plaat tot atomen. De positieve ionen nemen dus elektronen op uit de koperen plaat. Hetzelfde gebeurt aan de zinken kant. Hier verenigen de negatieve ionen uit de vloeistof zich met het zink, waarbij de negatieve ionen elektronen afstaan aan de zinken plaat.
Het gevolg is dat het systeem niet in evenwicht komt, er kunnen elektronen door het systeem blijven vloeien, namelijk:
- Van het zink naar het koper op de scheiding tussen beide metalen.
- Van het koper naar de positieve ionen uit de vloeistof.
- Van de negatieve ionen uit de vloeistof naar de zinken plaat.
Dat is de reden dat de cel van Volta niet maar heel eventjes, maar gedurende een vrij lange tijd spanning en stroom blijft produceren.
Perpetuüm mobile?
Het lijkt er op alsof de cel van Volta een echt perpetuüm mobile is. Het magische apparaat waar wetenschappers eeuwen naar gezocht hebben en dat voor eeuwig en altijd energie of beweging zou produceren. Ook Volta dacht een tijdje dat hij zo'n wonderlijk apparaat had uitgevonden. Immers: wie kan ontkennen dat de beschreven elektronenstroom niet voor altijd door de vloeistof en het koper/zink blijft vloeien?
Helaas is dat niet het geval en om dat te kunnen begrijpen is een zijsprong naar de chemie noodzakelijk. Zwavelzuur is een stof waarvan één molecuul (het kleinste deeltje zwavelzuur) bestaat uit zeven atomen:
- Twee waterstof atomen H.
- Een zwavel atoom S
- Vier zuurstof atomen O.
Volgens de afspraken in de chemie kunt u de formule van zwavelzuur dan ook schrijven als H2S04. Nu is het zo dat de vier atomen zuurstof een innige band hebben met het ene zwavel atoom. De twee waterstof atomen zijn veel losser aan het geheel gebonden. Het gevolg is dat, als u zwavelzuur verdunt met water, de waterstof atomen heel gemakkelijk uit het molecuulverband kunnen treden. Als gevolg van de elektrolytische dissociatie zullen de twee waterstof atomen uit het molecuul treden, waarbij echter hun elektronen achter blijven. Het gevolg is dat de reeds beschreven positieve ionen ontstaan, die dus in feite bestaan uit waterstof kernen. De negatieve ionen zijn opgebouwd uit de resterende atomen, dus zuurstof en zwavel. Het gevolg van de elektrolytische dissociatie is dus dat een molecuul zwavelzuur wordt gesplitst in twee positieve waterstof ionen H+ en een negatief S04- ion.
De positieve waterstof ionen migreren naar de koperen plaat en nemen daar het te veel aan elektronen op. Er ontstaat bijgevolg weer een neutraal waterstof atoom. De koperen plaat dan ook snel vol kleine gasbelletjes zitten, belletjes die bestaan uit zuiver waterstof. De negatieve ionen migreren naar de zinken plaat en geven daar hun te veel aan elektronen af. De S04-groep zal zich echter onmiddellijk met het zink van de plaat chemisch binden, waarbij zinksulfaat ZnS04 wordt gevormd. De zinken plaat wordt als het ware 'opgegeten' en zal langzaam maar zeker dunner worden. Het proces van het genereren van spanning gaat dus niet eeuwig door, maar tot alle zwavelzuur is omgezet in enerzijds waterstof en anderzijds zinksulfaat. Op dat moment kunnen er geen ionen meer in de oplossing ontstaan en kunnen er geen elektronen via de beschreven ingewikkelde elektrochemische weg worden overgezet van de koperen naar de zinken plaat. De spanning van het element valt weg en de Volta-cel kan alleen nieuw leven worden ingeblazen door opnieuw zwavelzuur in het water te gieten of door de zinken plaat te vervangen.
Polarisatie
In de praktijk zal de spanning van de cel echter veel eerder wegvallen. Op een bepaald moment sluiten niet alleen de zichtbare, maar ook de talloze onzichtbare microscopisch kleine waterstofgas belletjes de koperen plaat volledig af van het elektrolyt. De koperen plaat wordt dan als het ware geïsoleerd en er kan geen sprake zijn van elektronentransport. Dit verschijnsel noemt men de 'polarisatie' van de cel.
Conclusie
Hoe valt het te verklaren dat een elektrische cel een spanning opwekt? Als u het naadje van de kous wilt weten, dan komt u er snel achter dat dit een heel ingewikkeld proces is:
- Twee metalen met een verschillende arbeidsfunctie moeten in innig contact worden gebracht.
- Tegelijkertijd moeten beide metalen in een geïsoleerde bak worden opgesteld, waarin een elektrolyt aanwezig is.
- De elektronen die van het ene naar het andere metaal stromen kunnen, dankzij de elektrolytische dissociatie, via het elektrolyt weer terug vloeien van het andere naar het ene metaal.
- De elektronen worden door de vloeistof getransporteerd via ionen, die ontstaan door het uit elkaar vallen van de moleculen van de chemische stof die u in het water hebt opgelost.
- Door het elektronentransport via de ionen zullen deze ionen echter neerslaan op de twee platen.
- Hierbij zullen deze ionen chemische verbindingen aangaan met het metaal van een van de platen (of met beide platen), waardoor nieuwe chemische stoffen ontstaan.
- Hierdoor neemt de concentratie van de oorspronkelijk in het water opgeloste stof langzaam maar zeker af.
- Op een bepaald moment is alle oorspronkelijke stof chemisch omgezet en houdt het elektronentransport via de ionen door de vloeistof op.
- De cel levert dan geen elektrische spanning meer.
De spanningsreeks
Tussen de twee metalen platen ontstaat een spanningsverschil als gevolg van de elektrolytische dissociatie. Proeven hebben aangetoond dat de grootte van deze spanning afhankelijk is van de soort metalen die wordt gebruikt. U kunt dus een tabel opstellen waarin alle metalen gerangschikt worden naar de grootte van de spanning die zij genereren in een Volta-cel. Een dergelijke tabel noemt men de spanningsreeks. Zoals steeds als er sprake is van het definiëren van de grootte van een spanning, moet ergens een referentiepotentiaal gedefinieerd worden. In dit geval wordt hiervoor waterstof genomen, dat gelijk gesteld wordt met een potentiaal van 0 V. De spanningsreeks van de meest bekende metalen en andere stoffen is gegeven in onderstaande figuur. Aan de hand van deze spanningsreeks kunt u eenvoudig berekenen hoe het kwam dat Volta uit zijn zuil een spanning van 1,1 V haalde. De spanning van koper ten opzichte van waterstof bedraagt +0,34 V. De spanning van zink ten opzichte van waterstof bedraagt -0,76 V. U moet beide spanningen maar bij elkaar op te tellen om de spanning te weten die ontstaat in een cel die wordt gevormd uit zink- en koperplaten: 1,1 V. Nu moet wel opgemerkt worden dat ook het soort elektrolyt en de concentratie ervan een bepaalde rol spelen bij de uitgangsspanning die een cel kan afleveren.
 |
| De spanningsreeks van de in cellen en batterijen gebruikte materialen. (© 2017 Jos Verstraten) |
Om een elektrische cel met een maximale uitgangsspanning te maken moet u twee metalen kiezen die zo ver mogelijk uit elkaar liggen in de spanningsreeks en een voor deze metalen geschikt elektrolyt kiezen. Maar natuurlijk spelen ook andere factoren, zoals prijs, giftigheid, verkrijgbaarheid en lange termijn stabiliteit een zeer belangrijke rol.
In principe zijn er ontelbare combinaties van platen en elektrolyten mogelijk. Natuurlijk zullen niet alle combinaties praktisch bruikbaar zijn. Het komt er op neer een combinatie te vinden die:
- Goedkoop is.
- Niet te giftige stoffen bevat.
- Betrouwbaar is.
- Een vrij hoge celspanning levert.
- Niet te veel last heeft van polarisatie.
- Geen brandbare of giftige gassen produceert.
- Gemakkelijk en goedkoop te fabriceren is.
De cel van Volta komt om diverse redenen niet in aanmerking om het etiket 'praktisch bruikbare cel' opgeplakt te krijgen. Die eer komt toe aan Georges Leclanché.

De cel van Leclanché
Deze Fransman maakte in 1865 een cel, waarvan de samenstelling getekend is in onderstaande figuur. Deze cel gaat sindsdien door het leven onder de naam 'cel van Leclanché' en deze vormt nu nog steeds de basis van een heleboel goedkope batterijen die u in iedere supermarkt kunt kopen. De cel bestaat uit een glazen pot, die gevuld wordt met een verdunde oplossing van ammoniumchloride (salmiak) als elektrolyt. De ene elektrode wordt gevormd door een zinken staaf, de tweede door een staaf uit koolstof. De koolstof staaf hangt echter niet rechtstreeks in het elektrolyt, maar zit in een poreuze pot, die gevuld is met een mengsel van koolstofpoeder en magnesiumoxide. Deze stoffen gaan het polariseren van de cel tegen. Ook nu wordt op de positieve pool waterstofgas gevormd. Het magnesiumoxide zorgt er echter voor dat dit waterstofgas een chemische reactie aangaat, waardoor het gebonden wordt en de koolstaaf niet met microscopische gasbelletjes kan afsluiten. Uit de spanningsreeks kunt u afleiden dat de cel van Leclanché een spanning afgeeft van 0,74 V + 0,76 V = 1,5 V. De cel van Leclanché werd zeer lang overal toegepast. Het enige nadeel van de cel is dat de depolarisator vrij traag werkt. Als er een grote stroom uit de cel getrokken wordt, zal er zoveel waterstofgas rond de koolstaaf ontstaan, dat het magnesiumoxide niet in staat is dit om te zetten. Vandaar dat de cel dan toch langzaam polariseert, met als gevolg dat de spanning gaat dalen. Als u de cel nadien echter een tijdje niet belast zal het magnesiumoxide zijn werk blijven doen en het gevormde waterstof omzetten. Nadien levert de cel weer zijn volle spanning van 1,5 V.
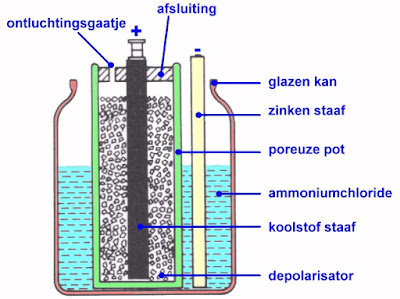 |
| De eerste uitvoering van de cel van Leclanché. (© 2017 Jos Verstraten) |
Moderne cellen volgens dit oeroude principe worden bijvoorbeeld gebruikt in platte batterijen van 4,5 V en de u maar al te bekende AA- en AAA-cellen van 1,5 V. In de platte batterij zijn drie Leclanché-cellen in serie geschakeld, waaruit de uitgangsspanning van 4,5 V verklaard wordt. Natuurlijk is het vrij onpraktisch om een cel te voorzien van een vloeistof als elektrolyt. U kunt echter ook een waterachtige pasta gebruiken, die de eigenschap heeft niet uit te vloeien. De samenstelling van zo'n moderne cel is getekend in onderstaande figuur. De zinken beker vormt nu zowel de behuizing van de cel als de negatieve pool. Als positieve pool wordt weer een koolstof staaf toegepast. Het elektrolyt wordt gevormd door een salmiak-oplossing te vermengen met bindmiddelen, waar vroeger zaagsel voor werd gebruikt. Op deze manier ontstaat een vrij vaste pasta, die echter toch nog waterig genoeg is om de elektrolytische dissociatie te laten plaatsvinden. Een dergelijke cel wordt 'droog' genoemd, omdat het elektrolyt aanwezig is onder de vorm van een pasta.
 |
| De samenstelling van een moderne 'droge' Leclanché-cel, bekend van de AA- en AAA-batterijtje van 1,5 V. (© 2017 Jos Verstraten) |

|

|
Koop uw 433 MHz modules bij Amazon


