
|
Een atoom is de kleinste nog als zodanig herkenbare bouwsteen van de materie. Vrijwel alle scheikundige en natuurkundige eigenschappen van de materie zijn gekoppeld aan de eigenschappen van atomen. 
|
De wijsheid van de oude filosofen
De oudheid
De prehistorische mens zag een groot rotsblok van een berg vallen en daardoor versplinteren in duizenden kleine brokstukken. Het ligt voor de hand dat deze prehistorische mens zich de vraag stelde of die kleine brokstukken op hun beurt weer te versplinteren waren en of het minuscuul kleine zandkorreltje van het strand ooit deel had uitgemaakt van zo'n groot indrukwekkend rotsblok. Of die prehistorische mens nog verder doordacht en zich de vraag stelde of dat zandkorreltje ook weer te versplinteren was in duizenden onzichtbaar kleine brokstukjes is uiteraard niet bekend.
| FORMULES IN DIT ARTIKEL |
|---|
| VERMENIGVULDIGEN:
Het vermenigvuldigingsteken wordt voorgesteld door een bullet tussen de factoren: a • b = c DELEN: Het gedeeld door teken wordt voorgesteld door een schuine streep: a / b = c |
Indiase en Griekse filosofen
Die vraag werd echter wél reeds gesteld door Indiase filosofen die zo'n 1.200 jaar voor onze jaartelling leefden en door Griekse filosofen als Democritus in de vijfde eeuw voor Christus. Deze denkers vonden het idee dat materie tot in het oneindige deelbaar was niet aantrekkelijk. Dat is ook logisch, want als men over dit probleem doordenkt is de logische consequentie van oneindig deelbare materie dat er in feite helemaal geen materie kan bestaan! De basis van alles zou dan immers een oneindig klein iets zijn en het is moeilijk in te zien hoe uit dit oneindig klein iets, iets kan ontstaan dat niet oneindig klein is.
Atomos
Ergens moet dus een allerkleinste brokje materie zijn, dat door de Grieken 'atomos' werd genoemd, letterlijk vertaald 'het ondeelbare'. Democritus veronderstelde dat deze atomen eeuwig bestonden, ondoordringbaar en hard waren en in de lege ruimte bewogen. De aard van deze beweging bepaalde de eigenschappen van de materie. Op deze manier werd verklaard hoe uit een beperk aantal verschillende atomen (water, aarde, lucht en vuur) alle stoffen konden ontstaan die in de natuur aanwezig waren. Ook de bekende Griekse filosoof Aristoteles nam de theorie van het atomos over, zij het dat hij deze kleinste ondeelbare materie 'minima naturalis' ofwel het 'natuurlijke minimum' noemde.
De atoomtheorie van Dalton
De negentiende eeuw
Het duurde tot het begin van de negentiende eeuw alvorens de wazige filosofische begrippen van de oude Grieken in een min of meer wetenschappelijke vorm werden geformuleerd. Die eer komt toe aan de Engelse chemicus John Dalton, die tussen 1803 en 1810 het boek 'A new system of chemical philosophy' publiceerde. In dit boek beschreef Dalton een beeld van de materie dat was gebaseerd op eenvoudige chemische proeven die veel eerder waren uitgevoerd door bijvoorbeeld de Fransman Lavoisier.
Lavoisier ontdekte dat bij chemische reacties tussen stoffen er steeds sprake is van gewichtsverhoudingen die met elkaar reageren. Zo reageert bijvoorbeeld 16 gram zuurstof (0) met 14 gram stikstof (N) en het resultaat is 30 gram stikstofmonoxide (NO). Is er teveel zuurstof of stikstof aanwezig, dan zal dat na de reactie onaangetast worden terug gevonden.
Dalton's veronderstellingen
Dalton formuleerde uit dergelijke experimenten de volgende veronderstellingen:
- Alle stoffen bestaan uit atomen.
- Er bestaat een beperkt aantal onderling verschillende atomen.
- Deze atomen zijn de kleinste materiedeeltjes.
- Deze atomen zijn ondeelbaar.
- De atomen hebben onderling bepaalde gewichtsverhoudingen.
- De eigenschappen van de stoffen worden bepaald door het soort atomen waaruit zij bestaan.
- Er bestaan bepaalde stoffen die uit slechts één soort atomen bestaan, deze stoffen werden 'elementen' genoemd.
- Chemische reacties ontstaan doordat de atomen van stoffen op de een of andere manier een verbinding met elkaar aangaan waardoor een nieuwe stof ontstaat met eigenschappen die niet te vergelijken zijn met de eigenschappen van de reagerende stoffen.
 |
| Verbinding van atomen chloor en natrium tot keukenzout volgens de theorie van Dalton. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Aan de hand van deze stellingen was Dalton in staat het begrip 'atoomgewicht' in te voeren. Het gewicht van atomen werd uitgedrukt door het te vergelijken met het gewicht van een standaard atoom. Als standaard gebruikte Dalton het gewicht van het waterstof atoom. Op deze manier kon hij een schaal met relatieve atoomgewichten opstellen en kreeg bijvoorbeeld het zuurstofatoom het atoomgewicht 16. Hoe nu een atoom er uitzag, daarover had Dalton geen enkel idee. In die tijd was dat ook niet noodzakelijk, want de eenvoudige theorie van Dalton met zijn atoomgewichten voldeed uitstekend voor het verklaren van chemische reacties.
De geheimzinnige kathodestralen
Elektrische geleiding van gassen
Dat er met de atomen van Dalton meer aan de hand was bleek toen de eerste experimenten met elektrische geleiding van gassen werden uitgevoerd. Zo bleek bijvoorbeeld dat een gas, in het algemeen een zeer slechte geleider van de elektrische stroom, onder bepaalde omstandigheden toch geleidend kan worden. Hoewel een groot aantal experimentatoren hebben bijgedragen aan het onderzoek van dit verschijnsel, wordt de eer van het ontdekken van de gasontlading toegekend aan Faraday. In de opstelling van Faraday worden twee elektroden ingesmolten in een glazen buisje. Tussen de elektroden wordt een grote gelijkspanning gezet. Als men nu de lucht uit de buis begint te pompen zal men op een bepaald moment vaststellen dat er in de buis een vreemd violet gekleurd licht ontstaat en dat er een elektrische stroom door de buis vloeit. Het lichteffect werd toegeschreven aan straling die afkomstig was uit de kathode en zich door het gas voortplantte. Deze straling werd vandaar 'kathodestraling' genoemd.
 |
| De proef van Faraday waarmee werd vastgesteld dat gassen onder bepaalde omstandigheden elektrische stroom geleiden. (© 2017 Jos Verstraten) |
In een ander experiment plaatste men een speciaal gevormde anode in het midden van een glazen kolf en bedekte men de vrije wand van de kolf met een fluorescerende laag. Men stelde vast dat de geheimzinnige straling de fluorescerende laag deed oplichten en dat een schaduw van de anode op de wand werd geprojecteerd.
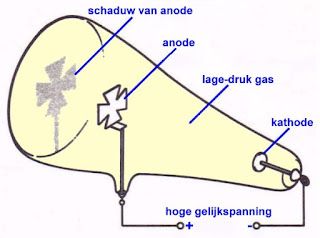 |
| Uit dit experiment blijkt dat de kathodestralen zich rechtlijnig voortplanten. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Eigenschappen van kathodestralen
Uit deze en andere experimenten leidde men een aantal eigenschappen van de kathodestralen af:
- De stralen planten zich rechtlijnig voort, want anders zou het schaduwbeeld van de anode op het scherm niet scherp zijn.
- De straling wordt afgebogen door een elektrostatisch veld.
- De straling wordt afgebogen door een magnetisch veld.
- De straling kan energie overbrengen, want als men een klein metalen plaatje in de baan van de straal zet wordt dit warm.
Jean Perrin
Een Franse professor aan de universiteit van Parijs, Jean Perrin, maakte de onderstaande proefopstelling. Hiermee werd een andere zeer belangrijke eigenschap van de kathodestralen aangetoond. De anode werd nu cilindervormig in het midden van de buis aangebracht en aan het vrije uiteinde werd een extra cilindervormige elektrode ingesmolten. Deze werd verbonden met de knop van een elektroscoop. Men stelde vast dat de kathodestralen die op de elektrode invielen de elektroscoop oplaadden. Door proeven kon men vaststellen dat de elektroscoop negatief werd opgeladen. De kathodestralen zijn dus dragers van negatieve elektrische lading.
 |
| De proef van Perrin, waaruit blijkt dat kathodestralen dragers zijn van negatieve elektrische lading. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Men begon toen te vermoeden dat de kathodestraling geen echte straling was, maar een stroom of bundel van negatief geladen deeltjes. Dat werd experimenteel bevestigd door de Engelse wetenschapper J. J. Thomson, die tussen 1894 en 1900 een reeks interessante proeven uitvoerde. In een gasontladingsbuis bracht Thomson twee evenwijdige elektroden aan, waartussen een spanning werd gelegd. Door het elektrostatisch veld dat tussen deze twee elektroden wordt opgebouwd zal de bundel geladen deeltjes worden afgebogen. In de buis werd bovendien een magnetisch veld aangebracht. Het magnetisch veld zorgt voor een tweede afbuiging van de deeltjesbundel. Door nu beide velden zo af te regelen dat hun afbuigende werkingen elkaar opheffen en wat gereken met de reeds toen bekende formules van de magnetische en elektrostatische krachten kon Thomson vrij nauwkeurig de verhouding tussen de lading en de massa van de deeltjes bepalen. Het bleek dat deze verhouding volledig onafhankelijk was van het soort gas in de buis en dat ook de samenstelling van het kathodemateriaal er niets toe deed. Blijkbaar waren deze geheimzinnige, negatief geladen deeltjes een fundamenteel onderdeel van alle materie.
Het experiment van Millikan
De wetenschapper Millikan slaagde er tussen de jaren 1909 en 1917 in de elektrische lading van deze nieuwe deeltjes zeer nauwkeurig te meten. Daarvoor werd een zeer ingenieuze en ingewikkelde opstelling ontwikkeld, die klassiek is geworden in de wetenschapshistorie. Aan de hand van de gevonden waarde van de lading en de resultaten van de proeven van Thomson kon men natuurlijk ook de massa vaststellen. De lading van het deeltje was 1,60218 • 10-19 C, de massa werd vastgesteld op het onvoorstelbare 9,10939 • 10-31 kg! Het nieuw ontdekte deeltje, dat elektron werd genoemd, moest dus wel onvoorstelbaar klein zijn!
 |
| De originele opstelling van Millikan, waarmee de lading van het elektron werd gemeten. (Wikimedia Commons) |
Het atoommodel van Thomson
Thomson stelt een nieuw atoommodel op
Aan de hand van al deze experimenteel verzamelde gegevens stelde Thomson een nieuw atoommodel op. Het atoom van Thomson bestond uit een homogeen bolletje met een positieve lading, waarin de negatief geladen elektronen waren 'ingebed'. De positieve pit had net zoveel lading als de elektronen, zodat het atoom op zich elektrisch neutraal was. De pitten zaten onderling in een hecht verband en de samenstelling van dit verband bepaalde de eigenschappen van de stof. Volgens Thomson was de stof dus zeer massief, want tussen de atomen was weinig vrije ruimte. Hoewel de positieve pit en de elektronen sterk aan elkaar gebonden waren, kon het toch door uitwendige invloeden gebeuren dat een of meerdere elektronen van de pit werden losgescheurd. Er bleef dan een atoompit over met een positieve lading, die 'ion' werd genoemd.
Een van die uitwendige invloeden was bijvoorbeeld het sterke elektrisch veld in de gasontladingsbuizen. Dit veld rukte de elektronen los van de pit, het gevolg was dat de kleine negatief geladen elektronen door de positieve anode werden aangetrokken. De veel zwaardere positieve ionen werden door de negatieve kathode aangetrokken. Vanwege het grote massaverschil tussen de zware ionen en de zeer lichte elektronen was de snelheid van de elektronen echter veel en veel groter dan deze van de ionen. De zeer snelle elektronenstroom veroorzaakte de kathodestraling en het oplichten van de fluorescerende schermen.
Het was natuurlijk nu ook duidelijk waarom de elektronenstraal werd afgebogen door een magnetisch of elektrisch veld. Geladen deeltjes ondergaan immers een kracht als zij zich door een elektrisch of magnetisch veld verplaatsen!
Wrijvingsverschijnselen verklaard
Het atoommodel van Thomson kon ook de reeds lang bekende verschijnselen van elektrische oplading door wrijving verklaren. Als men een glazen staaf krachtig wrijft met een wollen doek, dan zullen hierdoor elektronen uit de glasatomen worden losgerukt. Deze komen dan in de wollen doek terecht, waardoor hierin een teveel aan negatieve lading ontstaat. De glazen staaf is nu echter elektronen kwijt en wordt dus positief geladen.
 |
| De Thomson-verklaring van het verschijnsel van de wrijvingsoplading. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Het atoommodel van Rutherford
Rutherford strooit roet in het eten
Het mooie compacte atoommodel van Thomson bleek echter niet bestand tegen proeven die de Engelsman Rutherford rond 1906 uitvoerde. In 1896 werd door Becquerel het verschijnsel van de radioactiviteit ontdekt. Sommige atomen zenden straling uit, die in staat is zorgvuldig tegen licht afgeschermde fotografische platen toch te belichten. Deze geheimzinnige straling dringt dus blijkbaar zonder enig probleem door een papieren afscherming heen! Eén soort straling, die men α-straling (alpha) noemde, kon gemakkelijk worden gedetecteerd. Men vermoedde dat deze straling uit zware deeltjes bestaat die een positieve lading hebben. Nu weet men dat die α-straling niets anders is dan een stroom kernen van heliumatomen, die door sommige radioactieve stoffen wordt uitgezonden. Om de eigenschappen van deze nieuwe straling te onderzoeken schoot Rutherford een bundel van deze α-deeltjes af op een dunne gouden folie.
 |
| De strooiingsproeven van Rutherford betekenden het einde van het atoommodel van Thomson. (Wikimedia Commons, bewerkt door Jos Verstraten) |

Het atoommodel van Rutherford uit 1911
Uit deze en andere experimenten ontwierp Rutherford in 1911 een nieuw atoommodel, dat het 'planeet-model' werd genoemd. Een atoom bestaat volgens dit model uit een kleine harde kern met een positieve lading. Deze lading is gelijk aan of een geheel deel van het atoomgewicht van het atoom. Een waterstofkern (H) heeft dus een lading van +1, een zuurstofkern (O) van +8. Rond deze kern bewegen zich de negatief geladen elektronen in cirkelvormige banen. Alle elektronen hebben een lading van -1. Om het atoom elektrisch neutraal te houden cirkelen er even veel elektronen rond de kern als er positieve eenheidsladingen in de kern aanwezig zijn. Een waterstofatoom moet het dus stellen met slechts één elektron, een zuurstofatoom beschikt over acht elektronen.
Het grootste gedeelte van een atoom bevat dus niets anders dan lege ruimte, hetgeen verklaart waarom radioactieve α-straling zonder merkbare verzwakking door een dunne goudfolie kan dringen. De massa van het atoom zit voor het grootste deel geconcentreerd in de kern, de lichte elektronen dragen nauwelijks bij aan de massa.
Dit planeetmodel kon weer een heleboel fysische verschijnselen verklaren en had natuurlijk erg veel gelijkenis met de samenstelling van een zonnestelsel. Zoiets spreekt natuurkundigen, die immers uit filosofische overwegingen overtuigd zijn dat de natuur zichzelf in allerhande structuren steeds herhaalt, erg aan! Het atoommodel van Rutherford leek dan ook de definitieve verklaring van de bouw van de materie te zijn.
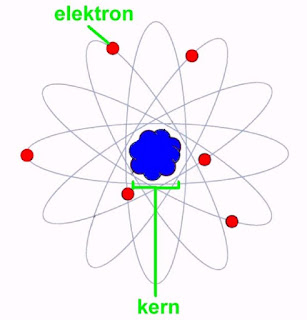 |
| Het atoommodel van Rutherford, opgesteld in 1911. (Wikimedia Commons, bewerkt door Jos Verstraten) |
Door statistische metingen uit te voeren en te tellen hoeveel a-deeltjes er door een folie vliegen en hoeveel er worden teruggekaatst kon Rutherford vrij nauwkeurig de straal van een atoom en de straal van de kern berekenen. De straal van het atoom bleek ongeveer 10-8 cm te zijn, de straal van de kern slechts 10-12 cm! De kern is dus 10.000 keer kleiner dan de diameter van het atoom, waaruit duidelijk blijkt dat materie heel ijl is en het heelal, de planeet aarde en ook wijzelf hoofdzakelijk uit niets bestaan. Dat, ondanks deze ijlheid, materie toch ongelooflijk stevig en hard kan zijn, heeft te maken met de grote krachten die in het atoom en tussen de atomen werkzaam zijn en de deeltjes stevig op hun plaats houden.
Verfijningen op het atoommodel van Rutherford
De banen van de elektronen
Ontelbare wetenschappers hebben jaren van hun leven besteed aan het aanbrengen van verfijningen in het atoommodel van Rutherford. Zo kon men experimenteel aantonen dat de elektronen niet zo maar rond de kern draaien, maar in welbepaalde cirkelvormige banen. Die banen noemt men de 'schillen' van het atoom en het blijkt dat iedere schil maar een beperkt aantal elektronen kan bevatten.
Er bestaan zeven schillen die worden aangeduid met de letters K, L, M, N, O, P en Q.
 |
| De zeven schillen van een atoom, waarop de elektronen volgens het model van Rutherford hun rondjes draaien. (© 2017 Jos Verstraten) |
Het maximaal aantal elektronen op iedere schil wordt gegeven door de eenvoudige wiskundige uitdrukking:
n = 2 • Z²
waarin Z het volgnummer van de schil voorstelt, gerekend van binnen naar buiten.
Schil K heeft dus Z = 1, schil N heeft Z = 4. Overigens geldt deze formule maar voor de schillen K, L, M en N. Nadien neemt het aantal elektronen weer af, maar wel volgens dezelfde reeks.
Een en ander betekent dus:
- Schil K bevat maximaal 2 elektronen.
- Schil L bevat maximaal 8 elektronen.
- Schil M bevat maximaal 18 elektronen.
- Schil N bevat maximaal 32 elektronen.
- Schil O bevat maximaal 18 elektronen.
- Schil P bevat maximaal 8 elektronen.
- Schil Q bevat maximaal 2 elektronen.

Atoombindingen
Dank zij het atoommodel van Rutherford kan men ook heel eenvoudig verklaren hoe atomen onderlinge bindingen aangaan en nieuwe stoffen vormen. In onderstaande figuur is bijvoorbeeld getekend hoe twee atomen waterstof (H) een verbinding aangaan met één atoom zuurstof (O) om één molecuul water (H2O) te vormen.
 |
| De verklaring van atoombindingen volgens het model van Rutherford (© 2017 Jos Verstraten) |
Te mooi om waar te zijn!
De natuur zorgt weer voor problemen
Ondanks het feit dat het atoommodel van Rutherford een heleboel fysische verschijnselen uitstekend kon verklaren, waren er toch een paar problemen.
- Het eerste probleem was dat volgens de elektromagnetische theorie die door Maxwell aan het eind van de negentiende eeuw werd opgesteld een elektrische lading in beweging per definitie elektromagnetische energie uitstraalt. Maar als die elektronen op hun banen dat zouden doen, dan zouden zij continu energie verliezen en daardoor binnen de kortste keren neerstorten op de kern van het atoom. Rutherford kon absoluut niet verklaren hoe de elektronen op hun constante banen bleven bewegen.
- Het tweede probleem was dat het model niet kon bewijzen waarom elektronen maar op bepaalde schillen rond de kern van het atoom kunnen cirkelen. In principe belet niets een elektron om een willekeurige baan op te zoeken. Toch was de aanwezigheid van de schillen ondubbelzinnig experimenteel aangetoond.
- Een derde probleem, hiermee samenhangend, was dat men kon aantonen dat atomen, onder bepaalde omstandigheden, elektromagnetische straling met zeer specifieke golflengtes uitzenden. Die specifieke golflengtes kunnen niet verklaard worden door het model van Rutherford.
Goed genoeg voor het verklaren van een heleboel verschijnselen
Ondanks deze problemen is het atoommodel van Rutherford uitstekend in staat een heleboel natuurkundige verschijnselen te verklaren. Een groot deel van de chemische verbindingen tussen atomen kan bijvoorbeeld met Rutherford worden verklaard. Ook de belangrijkste verschijnselen uit de elektrotechniek en de elektronica, zoals het ontstaan van elektrische stroom en het ontstaan van vrije elektronen, kunnen met het zeer eenvoudige atoommodel van Rutherford worden verklaard.

|

|
Koop uw voeding bij Banggood
